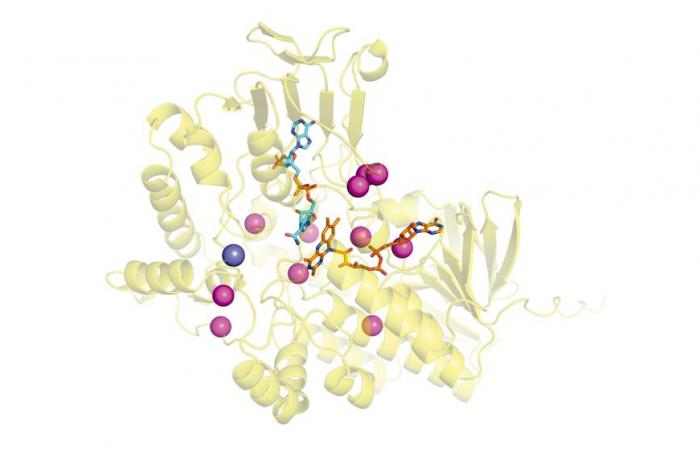
Une équipe de recherche internationale, dirigée par un scientifique du CONICET, a reconstitué l’évolution d’une famille d’enzymes à fort potentiel d’applications biotechnologiques : les monooxygénases de Baeyer-Villiger (BVMO). L’étude, publiée dans Rapports de cellules, Non seulement elle a déterminé quand ce groupe de molécules a développé la capacité d’utiliser l’oxygène, qui est essentielle pour remplir ses fonctions, mais elle ouvre également de nouvelles voies pour comprendre le développement de fonctions biologiques complexes, en fournissant de nouvelles données pour améliorer ses objectifs appliqués.
Les BVMO sont des enzymes qui prélèvent l’oxygène de l’air pour transformer des molécules par un processus d’oxydation. Grâce à une technique appelée « reconstruction de séquences ancestrales », qui permet de savoir, grâce à l’étude de ses ancêtres, comment une protéine acquiert une certaine fonction au fil du temps, l’équipe scientifique a reconstitué son histoire évolutive et détecté à quel moment a acquis la capacité de utiliser de l’oxygène.
Selon Laura Mascotti, chercheuse au CONICET à l’Institut d’histologie et d’embryologie de Mendoza (IHEM, CONICET-UNCUYO) et responsable de l’étude, ces enzymes existent dans les micro-organismes depuis des millions d’années, bien avant que l’atmosphère terrestre ne soit enrichie en oxygène. “Les BVMO sont des protéines très anciennes et nous pouvons retracer avec certitude leur évolution jusqu’aux premières populations bactériennes, un peu avant le ‘grand événement d’oxygénation’, il y a environ 2,5 à 2,3 millions d’années”, explique le scientifique récemment intégré à l’IHEM. de créer un groupe de biochimie évolutive, après plusieurs années de travail aux Pays-Bas.
« Notre idée était de comprendre quand ils ont acquis la capacité d’utiliser l’oxygène et comment. Pour ce faire, nous avons abordé le problème à partir de la biochimie évolutive, qui consiste en termes simples à étudier l’évolution de la famille des enzymes pour pouvoir retracer au fil du temps comment une fonction a changé ou comment elle l’a acquise. Pour nous, il est très important d’étudier cela car nous voulions comprendre comment les monooxygénases ont “appris” à utiliser l’oxygène”, ajoute le scientifique.
L’étude a montré que les BVMO ont évolué en une série d’étapes, commençant à partir d’une protéine sans activité et acquérant ensuite réactivité et spécificité jusqu’à devenir des enzymes actives. Pris ensemble, les résultats de l’étude illustrent comment un mécanisme catalytique intrinsèquement complexe a émergé au cours de l’évolution.
Les BVMO ont un fort potentiel pour les applications biotechnologiques, telles que la production de polymères. Cependant, ils n’ont pas encore pu être utilisés à grande échelle en raison de leur instabilité dans les conditions de fonctionnement et de la nécessité d’ajuster leur sélectivité, dans certains cas. La science visant à approfondir son fonctionnement, et celui des enzymes en général, permet d’améliorer son application pratique. “La biochimie évolutive génère des résultats qui sont essentiels à l’application ultérieure de conceptions rationnelles ou semi-rationnelles de variantes d’enzymes avec une application industrielle, car elle nous permet de connaître et de définir quels sont les « déterminants fonctionnels » d’une enzyme.. D’un autre côté, je pense qu’il convient de souligner que la reconstruction de séquences ancestrales n’est pas simplement un autre outil de génie génétique, mais plutôt une approche de « disséquer/démêler » les fonctionnalités et qui peut générer des connaissances inestimables qui seront ensuite utilisées à des fins appliquées.», conclut le scientifique.
Référence bibliographique
Guang Yang, Ognjen Pećanac, Hein J. Wijma, Henriëtte J. Rozeboom, Gonzalo de Gonzalo, Marco W. Fraaije, Maria Laura Mascotti (2024) Evolution du mécanisme catalytique à l’aube des monooxygénases Baeyer-Villiger. Rapports de cellules. https://doi.org/10.1016/j.celrep.2024.114130